Under PCR-reaksjonen oppstår det ofte noen interfererende faktorer.
På grunn av PCRs svært høye sensitivitet, anses kontaminering å være en av de viktigste faktorene som påvirker PCR-resultatene, og kan gi falskt positive resultater.
Like kritiske er de ulike kildene som fører til falskt negative resultater. Hvis en eller flere viktige deler av PCR-blandingen eller selve amplifiseringsreaksjonen hemmes eller forstyrres, kan den diagnostiske analysen bli hindret. Dette kan føre til redusert effektivitet og til og med falskt negative resultater.
I tillegg til hemming kan tap av målnukleinsyrens integritet oppstå på grunn av forsendelses- og/eller lagringsforhold før prøvepreparering. Spesielt høye temperaturer eller utilstrekkelig lagring kan føre til skade på celler og nukleinsyrer. Celle- og vevsfiksering og parafininnstøping er velkjente årsaker til DNA-fragmentering og et vedvarende problem (se figur 1 og 2). I disse tilfellene vil selv optimal isolering og rensing ikke hjelpe.
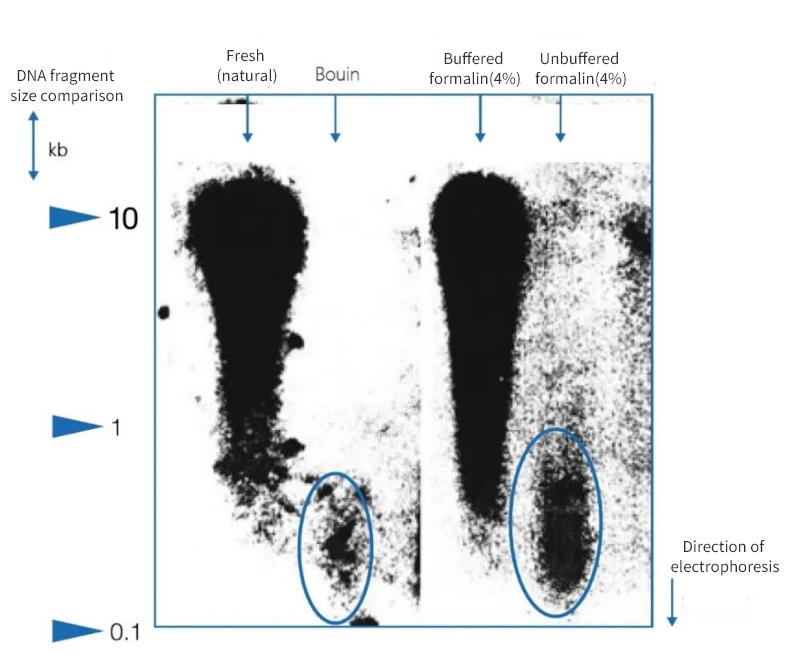
Figur 1 | Effekt av immobilisering på DNA-integritet
Agarosegelelektroforese viste at kvaliteten på DNA-et isolert fra parafinsnitt fra obduksjoner varierte betydelig. DNA med ulik gjennomsnittlig fragmentlengde var tilstede i ekstraktene avhengig av fikseringsmetoden. DNA ble kun bevart når det ble fiksert i native frosne prøver og i bufret nøytral formalin. Bruk av et sterkt surt Bouin-fiksativ eller ubufret, maursyreholdig formalin resulterte i et betydelig tap av DNA. Den gjenværende fraksjonen er svært fragmentert.
Til venstre er lengden på fragmentene uttrykt i kilobasepar (kbp)
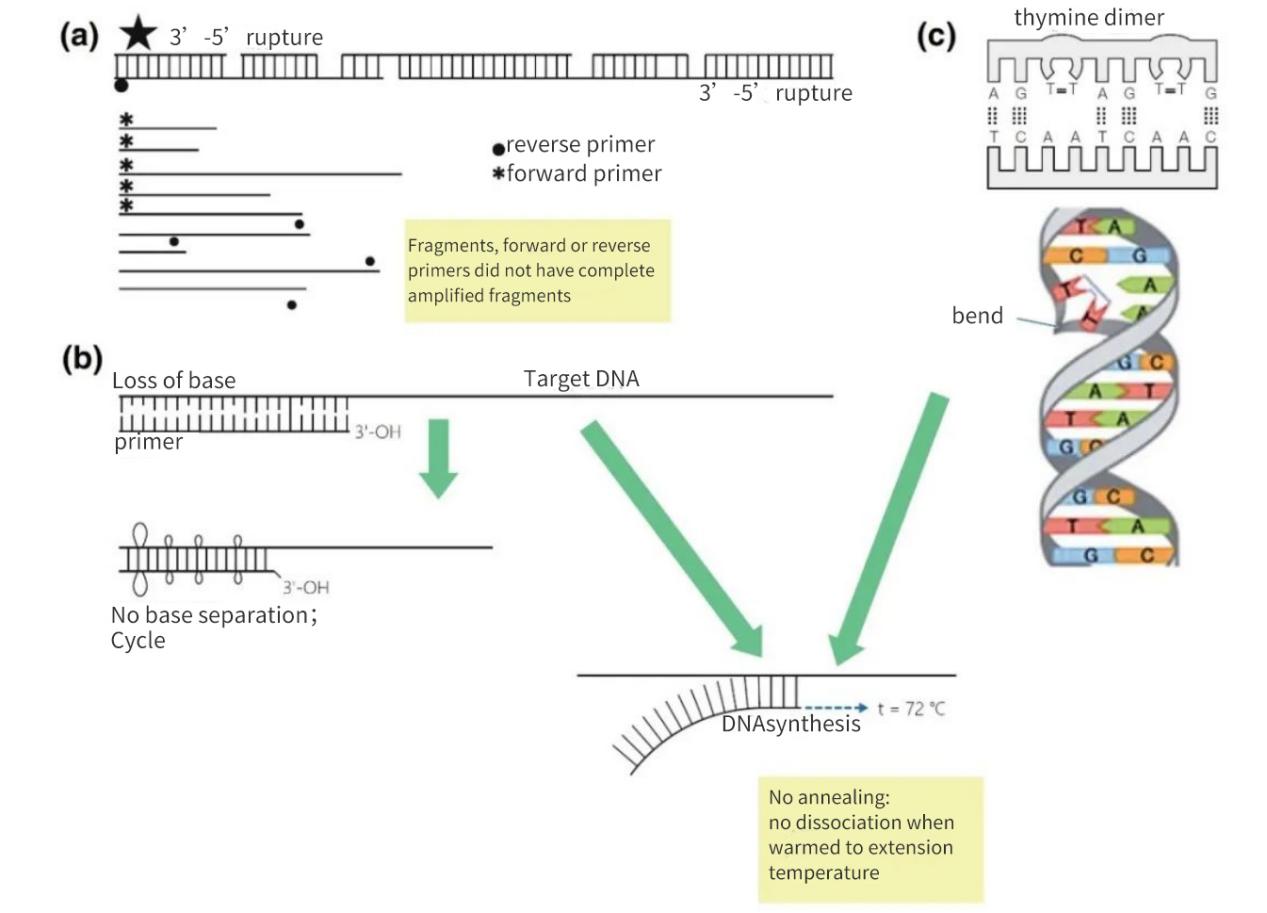
Figur 2 | Tap av integritet hos nukleinsyremål
(a) Et 3′-5′ gap på begge trådene vil resultere i et brudd i mål-DNA-et. Syntese av DNA vil fortsatt forekomme på det lille fragmentet. Men hvis et primerbindingssted mangler på DNA-fragmentet, skjer det bare lineær amplifisering. I det gunstigste tilfellet kan fragmentene mette hverandre på nytt, men utbyttet vil være lite og under deteksjonsnivåene.
(b) Tap av baser, hovedsakelig på grunn av depurinering og dannelse av tymidindimer, fører til en reduksjon i antall H-bindinger og en reduksjon i Tm. I løpet av den forlengede oppvarmingsfasen vil primerne smelte bort fra matriks-DNA-et og vil ikke anneale selv under mindre strenge forhold.
(c) Tilstøtende tyminbaser danner en TT-dimer.
Et annet vanlig problem som ofte oppstår i molekylærdiagnostikk er mindre optimal frigjøring av målnukleinsyrer sammenlignet med fenol-kloroform-ekstraksjon. I ekstreme tilfeller kan dette være forbundet med falske negative resultater. Mye tid kan spares ved kokende lysis eller enzymatisk fordøyelse av celleavfall, men denne metoden resulterer ofte i lav PCR-følsomhet på grunn av utilstrekkelig nukleinsyrefrigjøring.
Inhibering av polymeraseaktivitet under amplifisering
Generelt brukes inhibering som et beholderbegrep for å beskrive alle faktorer som fører til suboptimale PCR-resultater. I en strengt biokjemisk forstand er inhibering begrenset til enzymets aktivitet, dvs. at den reduserer eller forhindrer substrat-produkt-konvertering gjennom interaksjon med det aktive setet til DNA-polymerasen eller dens kofaktor (f.eks. Mg2+ for Taq DNA-polymerase).
Komponenter i prøven eller ulike buffere og ekstrakter som inneholder reagenser kan direkte hemme enzymet eller fange dets kofaktorer (f.eks. EDTA), og dermed inaktivere polymerasen og dermed føre til reduserte eller falskt negative PCR-resultater.
Imidlertid betegnes mange interaksjoner mellom reaksjonskomponenter og målholdige nukleinsyrer også som «PCR-hemmere». Når cellens integritet forstyrres av isolering og nukleinsyren frigjøres, kan det oppstå interaksjoner mellom prøven og den omkringliggende løsningen og faste fasen. For eksempel kan «fjernere» binde enkelt- eller dobbelttrådet DNA gjennom ikke-kovalente interaksjoner og forstyrre isolering og rensing ved å redusere antallet mål som til slutt når PCR-reaksjonsbeholderen.
Generelt sett finnes PCR-hemmere i de fleste kroppsvæsker og reagenser som brukes til kliniske diagnostiske tester (urea i urin, hemoglobin og heparin i blod), kosttilskudd (organiske komponenter, glykogen, fett, Ca2+-ioner) og komponenter i miljøet (fenoler, tungmetaller).
| Inhibitorer | Kilde |
| Kalsiumioner | Melk, beinvev |
| Kollagen | Vev |
| Gallesalter | Avføring |
| Hemoglobin | I blod |
| Hemoglobin | Blodprøver |
| Humussyre | Jord, plante |
| Blod | Blod |
| Laktoferrin | Blod |
| (europeisk) melanin | Hud, hår |
| Myoglobin | Muskelvev |
| Polysakkarider | Plante, avføring |
| Protease | Melk |
| Urea | Urin |
| Mukopolysakkarid | Brusk, slimhinner |
| Lignin, cellulose | Planter |
Mer vanlige PCR-hemmere finnes i bakterier og eukaryote celler, ikke-mål-DNA, DNA-bindende makromolekyler i vevsmatriser og laboratorieutstyr som hansker og plast. Rensing av nukleinsyrer under eller etter ekstraksjon er den foretrukne metoden for å fjerne PCR-hemmere.
I dag kan diverse automatiserte ekstraksjonsutstyr erstatte mange manuelle protokoller, men 100 % gjenvinning og/eller rensing av mål har aldri blitt oppnådd. Potensielle inhibitorer kan fortsatt være tilstede i de rensede nukleinsyrene eller kan allerede ha virket. Ulike strategier finnes for å redusere virkningen av inhibitorer. Valg av passende polymerase kan ha en betydelig innvirkning på inhibitoraktiviteten. Andre velprøvde metoder for å redusere PCR-hemming er å øke polymerasekonsentrasjonen eller bruke tilsetningsstoffer som BSA.
Hemming av PCR-reaksjoner kan demonstreres ved bruk av intern prosesskvalitetskontroll (IPC).
Det må utvises forsiktighet for å fjerne alle reagenser og andre løsninger i ekstraksjonssettet, som etanol, EDTA, CETAB, LiCl, GuSCN, SDS, isopropanol og fenol, fra nukleinsyreisolatet ved et grundig vasketrinn. Avhengig av konsentrasjonen kan de aktivere eller hemme PCR.
Publisert: 19. mai 2023
 中文网站
中文网站